-

-

- Мои разделы
-
 Мои друзья(0)
Мои друзья(0) -
 Мои фото(0)
Мои фото(0) -
 Мои дневники(0)
Мои дневники(0) -
 Моя музыка(0)
Моя музыка(0) - Разделы сайта
-
 Раздел сервисы и загрузок 14
Раздел сервисы и загрузок 14 -
 Раздел развлечения 18
Раздел развлечения 18 -
 Раздел онлайн игр 76
Раздел онлайн игр 76 -
 ✴Банды сайта❗✴ (1/3)
✴Банды сайта❗✴ (1/3) -
 ⭐Лидеры дня❗⭐ (0)
⭐Лидеры дня❗⭐ (0) -
 ☀День рождения❗☀
☀День рождения❗☀ -
 ☀Новости сайта❗☀ (21)
☀Новости сайта❗☀ (21) -
 ⭐Топ пользователей❗⭐
⭐Топ пользователей❗⭐ -
 ❤Даты праздников❗❤ 255/152
❤Даты праздников❗❤ 255/152 -
 ⭐Фотогалерея сайта❗⭐ (107)
⭐Фотогалерея сайта❗⭐ (107) -
 ☀Статусы обитателей ❗☀ (19)
☀Статусы обитателей ❗☀ (19) -
 ❤Дневники сайта❗❤ (1)
❤Дневники сайта❗❤ (1)
-
 Микроблоги 6
Микроблоги 6 -
 ❇Форум сайта❗❇ (55/90)
❇Форум сайта❗❇ (55/90) -
 ⭐Файловый обменник❗⭐ (3)
⭐Файловый обменник❗⭐ (3)
-
 ✴Анаграмма❗✴ 0 человек
✴Анаграмма❗✴ 0 человек
-
 ☀Администрация сайта❗☀ (1)
☀Администрация сайта❗☀ (1) -
 ✳Викторина❗✳ 0 человек
✳Викторина❗✳ 0 человек -
 ☀Чат сайта❗☀ (0 человек)
☀Чат сайта❗☀ (0 человек) -
 ❤Бракосочетания❗❤ (2 )
❤Бракосочетания❗❤ (2 ) -
 ❤Война полов❤
❤Война полов❤ -
 ❤VIP Знакомства❤ 264
❤VIP Знакомства❤ 264 -
 ❤Обитатели сайта❗❤ М :136 | Ж :128
❤Обитатели сайта❗❤ М :136 | Ж :128
-
 ☀Острослов☀
☀Острослов☀ -
 Сказочный бонус (83)
Сказочный бонус (83) -
 ✴Ежедневный подарок❗✴ (27)
✴Ежедневный подарок❗✴ (27) -
 Аукцион Джинов
Аукцион Джинов -
 Зарница (3)
Зарница (3) -
 ❤Лотерея❤
❤Лотерея❤ -
 Спортлото 6 из 36
Спортлото 6 из 36 -
 Русская рулетка (35)
Русская рулетка (35) -
 Моя удача
Моя удача - Дополнительно
-
 Выход
Выход
 Получить зарплату💸💰💳
Получить зарплату💸💰💳
 Банк сайта
Банк сайта💌mirsoc.ru
Ученые заставили белки работать "всухую"
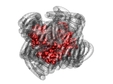
Ученые установили, что наличие воды не является обязательным условием для нормальной подвижности и работы миоглобина. Работа опубликована в журнале Journal of the American Chemical Society, а ее краткое содержание приводит New Scientist.
Работа большинства белков, и прежде всего ферментов, связана с внутримолекулярной подвижностью. Под ней подразумевается движение различных структур внутри белковой молекулы друг относительно друга.
Авторы исследования заинтересовались тем, как изменится подвижность в пептиде, если ассоциированную с ним воду заменить на сурфактанты - поверхностно активные полимеры. Ученые провели такую замену в миоглобине, а затем проследили за внутримолекулярной динамикой при помощи рассеивания нейтронов. При этом благодаря замене водорода на дейтерий в составе сурфактанта ученые могли отдельно наблюдать за движениями самого белка и окружающей его полимерной "шубы".
Данные рассеяния показали, что использованию сурфактантов миоглобин остался практически таким же гибким и подвижным, как в присутствии воды. Он по-прежнему связывал и отпускал кислород, не смотря на то, что это сопровождается изменениями в трехмерной структуре полипептида и требует значительных внутримолекулярных движений.
До сих пор биофизики считали, что для существования такой подвижности с молекулой белка должно быть связано большое количество молекул воды, служащей для поддержания структуры и "смазывающей" трение отдельных частей пептида. Полученные результаты могут пригодиться для изготовления искусственных систем катализа и фотосинтеза.

