-

-

- Мои разделы
-
 Мои друзья(0)
Мои друзья(0) -
 Мои фото(0)
Мои фото(0) -
 Мои дневники(0)
Мои дневники(0) -
 Моя музыка(0)
Моя музыка(0) - Разделы сайта
-
 Раздел сервисы и загрузок 14
Раздел сервисы и загрузок 14 -
 Раздел развлечения 18
Раздел развлечения 18 -
 Раздел онлайн игр 76
Раздел онлайн игр 76 -
 ✴Банды сайта❗✴ (1/3)
✴Банды сайта❗✴ (1/3) -
 ⭐Лидеры дня❗⭐ (0)
⭐Лидеры дня❗⭐ (0) -
 ☀День рождения❗☀
☀День рождения❗☀ -
 ☀Новости сайта❗☀ (21)
☀Новости сайта❗☀ (21) -
 ⭐Топ пользователей❗⭐
⭐Топ пользователей❗⭐ -
 ❤Даты праздников❗❤ 255/152
❤Даты праздников❗❤ 255/152 -
 ⭐Фотогалерея сайта❗⭐ (106)
⭐Фотогалерея сайта❗⭐ (106) -
 ☀Статусы обитателей ❗☀ (19)
☀Статусы обитателей ❗☀ (19) -
 ❤Дневники сайта❗❤ (1)
❤Дневники сайта❗❤ (1)
-
 Микроблоги 6
Микроблоги 6 -
 ❇Форум сайта❗❇ (55/90)
❇Форум сайта❗❇ (55/90) -
 ⭐Файловый обменник❗⭐ (3)
⭐Файловый обменник❗⭐ (3)
-
 ✴Анаграмма❗✴ 0 человек
✴Анаграмма❗✴ 0 человек
-
 ☀Администрация сайта❗☀ (1)
☀Администрация сайта❗☀ (1) -
 ✳Викторина❗✳ 0 человек
✳Викторина❗✳ 0 человек -
 ☀Чат сайта❗☀ (0 человек)
☀Чат сайта❗☀ (0 человек) -
 ❤Бракосочетания❗❤ (2 )
❤Бракосочетания❗❤ (2 ) -
 ❤Война полов❤
❤Война полов❤ -
 ❤VIP Знакомства❤ 263
❤VIP Знакомства❤ 263 -
 ❤Обитатели сайта❗❤ М :135 | Ж :128
❤Обитатели сайта❗❤ М :135 | Ж :128
-
 ☀Острослов☀
☀Острослов☀ -
 Сказочный бонус (83)
Сказочный бонус (83) -
 ✴Ежедневный подарок❗✴ (27)
✴Ежедневный подарок❗✴ (27) -
 Аукцион Джинов
Аукцион Джинов -
 Зарница (3)
Зарница (3) -
 ❤Лотерея❤
❤Лотерея❤ -
 Спортлото 6 из 36
Спортлото 6 из 36 -
 Русская рулетка (35)
Русская рулетка (35) -
 Моя удача
Моя удача - Дополнительно
-
 Выход
Выход
 Получить зарплату💸💰💳
Получить зарплату💸💰💳
 Банк сайта
Банк сайта💌mirsoc.ru
Программа поможет собирать "белковый конструктор"
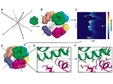
Ученые создали технологию рационального дизайна белковых комплексов de novo. Она позволит создавать из полипептидов искусственные структуры, обладающие заранее рассчитанными свойствами. Работа опубликована в журнале Science.
Рациональный дизайн состоит из нескольких этапов. Во-первых, исследователи выбирают тип симметрии желаемого комплекса. Затем в соответствии с ним подбирается полипептид, который станет "строительным блоком" будущей структуры. Им могут стать разные белки, которые не обязательно образуют комплексы в природе. Единственное ограничение - структура белков должна содержать элементы симметрии, соответствующие симметрии комплекса.
На следующем этапе собирается первоначальная структура, элементы которой затем тщательно подгоняются друг к другу. На завершающей стадии ученые вставляют в последовательность полипептидов такие аминокислоты, которые будут образовывать связи между контактирующими поверхностями.
В качестве иллюстрации возможности разработанной технологии авторы создали два комплекса размерами 13 и 11 нанометров. Один из них обладал октаэдрической симметрией и содержал 24 субъединицы, а другой имел тетраэдрическую симметрию и включал 11 субъединиц. Ученые клонировали разработанные белки в рекомбинантные организмы, получили комплексы и установили их строение методом рентгеноструктурного анализа. Положение атомов в комплексе практически не отличалось от предсказанного программой.
Ранее эта же группа ученых смогла рационально изменить структуру двух белков так, чтобы они связывались с поверхностью вируса гриппа.
Разработанная технология важна для понимания связи между последовательностью белка и его структурой. Кроме того, она представляет собой альтернативу созданию комплексов из нуклеиновых кислот с помощью метода ДНК-оригами (или сборке комплексов из коротких олигонуклеотидов). Подобные структуры исследователи надеются применить для создания молекулярных нанороботов. Структуры из белков могут оказаться более практичными, чем из ДНК, так как пептиды обладают большим разнообразием химических свойств и потенциально должны быть более устойчивы к неблагоприятным внешним условиям.

